Каква е реакцията на сребърното огледало? Химичен експеримент: получаване на сребърно огледало Защо реакция с амонячен разтвор на сребърен оксид.
Лаборатория № 5
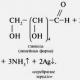
Имотивъглехидрати
Експеримент 1. Реакция на сребърно огледалое реакция на възстановяване среброот амонячен разтвор сребърен оксид (Толенов реагент).
във воден разтвор амоняксребърният оксид се разтваря, за да образува комплексно съединение - диамминсребър(I) хидроксид ОН
когато се добави към което алдехидпротича редокс реакция с образуването на метално сребро:
Ако реакцията се извършва в съд с чисти и гладки стени, тогава среброто се утаява под формата на тънък филм, образувайки огледална повърхност.
При най-малко замърсяване среброто се отделя под формата на сива рохкава утайка.
Реакцията на сребърното огледало може да се използва като качествен тест за алдехиди. Така реакцията на "сребърното огледало" може да се използва като разграничение между глюкозаи фруктоза. Глюкозата принадлежи към алдозите (съдържащи отворена алдехидна група), а фруктозата принадлежи към кетозите (съдържащи отворена кето група). Следователно глюкозата дава реакция на "сребърно огледало", докато фруктозата не. Но ако в разтвора присъства алкална среда, тогава кетозите се изомеризират в алдози и също така дават положителни реакции с разтвор на амоняк сребърен оксид (Толенов реагент).
Качествена реакция на глюкоза с амонячен разтвор на сребърен оксид.Можете да докажете наличието на алдехидна група в глюкозата с помощта на амонячен разтвор на сребърен оксид. Добавете разтвор на глюкоза към амонячен разтвор на сребърен оксид и загрейте сместа на водна баня. Скоро метално сребро започва да се отлага по стените на колбата. Тази реакция се нарича реакция на сребърното огледало. Използва се като качество за откриване на алдехиди. Алдехидната група на глюкозата се окислява до карбоксилна група. Глюкозата се превръща в глюконова киселина.
CH 2 OH - (CHOH) 4 – СЪН+Ag 2 О= CH 2 OH - (CHOH) 4 – COOH + 2Ag↓

Редът на работата.
Изсипете 2 ml в две епруветки. амонячен разтвор на сребърен оксид. Към един от тях се добавят 2 мл. 1% разтвор на глюкоза, в друг - фруктоза. И двете тръби кипят.
Амонячен разтвор на сребърен хидроксид се получава чрез взаимодействие на сребърен нитрат с натриев хидроксид и амониев хидроксид:
AgNO3+ NaOH → AgOH↓+ NaNO3,
AgOH + 2 NH4 OH→[Ag(NH3)2] OH + H2O,
амонячен разтвор
OH + 3 H2 → Ag2O + 4 NH4 OH.
Принципът на метода. По стените на епруветката с глюкоза се образува огледало в резултат на отделянето на метално сребро.
Оформяне на работа: Заключението, както и хода и уравненията на реакцията напишете в тетрадка.
Опит 3. Качествена реакция към фруктоза
Принципът на метода. Когато проба с фруктоза се нагрява в присъствието на резорциноли на солна киселинадо 80 ° C след известно време в епруветка с фруктоза се появява яркочервен цвят.
Когато проба с фруктоза се нагрява в присъствието на резорциноли на солна киселинасе появява вишнево червен цвят. Анализът е приложим и за откриване на други кетоза. Алдозипри същите условия те взаимодействат по-бавно и дават бледорозов цвят или изобщо не си взаимодействат. отворен Ф. Ф. Селивановпрез 1887г. Използва се при анализ на урината. Тестът е положителен за фруктозурия от метаболитен или транспортен произход. В 13% от случаите тестът е положителен при хранителен товар от плодове и мед. Chem. формулафруктоза - C 6 H 12 O 6

Цикличната формула на фруктозата
Ациклична форма 
фруктоза
Боядисана връзка
R-остатък
хидроксиметилфурфурол
Редът на работата.
2 ml се изсипват в две епруветки: в едната - 1% разтвор на глюкоза, в другата - 1% разтвор на фруктоза. И двете епруветки се пълнят с 2 ml реактив на Селиванов: 0,05 g резорцинол се разтварят в 100 ml 20% солна киселина. И двете тръби се загряват леко до 80°C (преди кипене). Появява се червен цвят.

Изводи: резултатите от експеримента и уравнението на реакцията се записват в тетрадка.
Продължаваме темата за химическите експерименти, защото се надяваме, че определено ще ви харесат. Този път представяме на вашето внимание още едно увлекателно изживяване, по време на което ще получим сребърно огледало.
Нека започнем с гледане на видеото
ще ни трябва:
- капацитет;
- сребърен нитрат;
- топла вода;
- разтвор на амоняк 10%;
- глюкоза;
- алкохолна горелка

Да започнем със сребърен нитрат. Взимаме около грам от него и го разреждаме в малко количество гореща вода.

След това към получения разтвор се добавя натриев хидроксид. По време на тази реакция се образува сребърен оксид, който се утаява.

След това добавете 10% разтвор на амоняк към утайката от сребърен оксид. Необходимо е да се излее разтвор на амоняк, докато утайката се разтвори.

По време на тази реакция се образува сребърен амоняк. Добавете 5 грама глюкоза към получения разтвор.

Сега трябва да загреете получената смес. За да направите това, запалваме алкохолната горелка и поставяме чаша върху нея, така че сместа постепенно да се нагрява. По време на тази реакция се отделя много голямо количество амоняк, така че тази реакция трябва да се проведе или под камина, или на открито. По време на реакцията може да се образува и сребърен нитрит, който е много опасно вещество, така че съдовете трябва да се измият старателно след реакцията.


След известно време тънък слой сребро постепенно започва да се утаява по стените на чашата. Реакцията завършва след около 15 минути след началото на нагряването.


За да получите по-равномерен слой сребро, трябва да поставите чаша със сместа в голям съд, да налеете гореща вода в съда и да го поставите на горелка за алкохол. Така температурата ще бъде разпределена равномерно и резултатът ще бъде по-зрелищен.
Провеждане на избираема дисциплина "Експеримент по органична химия"
Изучаване на урока
Практическа работа No3 "Реакцията на сребърното огледало"
Предмет: Изследване на взаимодействието на органични съединения от различни класове със сребърни (I) съединения.
Целта на урока:
общо образование
Изследвайте взаимодействието на класове органични съединения със сребърни съединения, открийте причината за избора на това взаимодействие.
Образователни
Развитие на мисловни умения, сравнение, анализ, синтез на когнитивни умения. Умение да поставяте и задавате въпрос, да формулирате проблем, да правите изводи; усъвършенстване на уменията за самостоятелно поведение.
Дидактически
Да се формират компетенции в областта на самостоятелната познавателна дейност, умения за работа в екип, способност да се види проблема и да се очертаят начини за решаването му.
Образователни
Формирането на мирогледно мислене, разширяване на хоризонтите, формиране на положително отношение към изучаването на предмета, навик да се помага на другарите, добросъвестно отношение към изпълняваната задача, развиване на взискателност към себе си и другарите.
Методи: изследване, работа с учебна литература, частично търсене, лабораторна работа, работа в групи.
Оборудване: На ученическите маси, инструменти и реактиви за лабораторна работа “Реакция на сребърно огледало”, карти със задачи, презентация за урока.
По време на занятията
1. Организационен момент
„Времето за чудеса отмина и ние
Търся причини
Всичко, което се случва в света"
У. Шекспир
(слайд номер 1)
Встъпително слово на учителя : Всеки, който има представа за науката химия, знае, че неразделна част от нея е химическият експеримент. Забавните експерименти и практически упражнения помагат за развитието на химическото мислене и допринасят за усвояването на химията. Избираемата дисциплина "Изучаване на органична химия чрез система от експериментални задачи" е предназначена за 17 часа 12 - практическа работа. По-голямата част от практическата работа се извършва от малки групи студенти. Курсовата работа е структурирана по следния начин. Студентите получават задачи по темата на предстоящата практическа работа. У дома те се запознават с теоретичния материал, изучават съдържанието на самата работа.
Днес правим практическа работа №3 (виж заглавието по-горе)
(слайд номер 2)
Целта на тази работа: експериментално да се изследва взаимодействието на класове органични съединения със сребърни съединения, да се установи причината за избора на това взаимодействие, да се консолидират практическите умения, необходими в дейността на експериментатора.
(слайд номер 3)
Учениците получиха предварителна задача за урока.
учител : Реакцията на взаимодействие на сребърното съединение се нарича "реакция на сребърното огледало". Разкажете историята на получаването на това огледало.
1 ученик : История на придобиване на огледало. Огледала… Segoденят е много често срещано нещо в живота ни. Малко хора знаят, че огледалата са се появили много преди нашата ера. Първоначално те бяха метални пластини, полирани до блясък, изработени от злато, сребро, мед или бронз. Производството на огледала от съвременен тип (върху стъкло) е започнато през 1858 г. от немския химик Юстус Либих. Той използва за това способността на сребърните катиони да образуват множество комплексни съединения.Веднъж, след измиване на вътрешната повърхност на колбата с разтвор на сода, а след това с вода, етилов алкохол и диетилов етер, Либих излива в нея малко разреден формалин - 10% разтвор на формалдехид. След това, добавяйки към формалина разтвор на сребърен амоняк от състава, той внимателно загрява колбата.След няколко минути колбата се превърна в огледало.
Сложният катион, съдържащ сребро, се редуцира до метал (сребро), а формалдехидът се окислява до мравчена киселина HCOOH. Впоследствие, вместо формалин, Юстус Либих използва глюкоза, за да получи "сребърно огледало".
учител : Разкажете ни за историята на получаването на реактива на Толенс, който се използва широко в аналитичната химия.
2 ученик: Историята на получаването на реактива на Толенс. През 1881 г. немският химик Бернхард Кристиан Толенс предлага използването на сребърно комплексно съединение за откриване на съединения с алдехидна група в разтвор. Когато воден разтвор на амоняк се добави към разтвор на сребърен нитрат, се получава утайка от сиво-черен оксид, тъй като сребърният хидроксид не съществува при нормални условия.
2AgNO 3 + 2NH 4 OH → Ag 2 O + 2NH 4 NO 3 + H 2 O
Сребърният оксид се разтваря в излишната амонячна вода, образува комплексединство.
Ag 2 O + 4NH 4 OH → 2 OH + 3H 2 O
Полученият безцветен разтвор е наречен реагент на Толенс.
2. Основно тяло
„Невъзможно е да станеш химик по никакъв начин,
Без да видя самата практика
и да не предприемаме химически операции"
М.В. Ломоносов
(слайд номер 4)
А) Ролева игра: Класът е изследователска лаборатория, която започва своята работа по изучаване на взаимодействието на различни класове органични съединения със сребърни (I) съединения. Учениците са разделени в три творчески групи. Всяка творческа група разполага с информационен отдел и химическа лаборатория. Групите получават теоретични и практически задачи и работа (5-7 мин.). Заедно със задачата се издават указания за провеждане на експеримента. (слайд номер 5)
Задача 1 творческа група
Задача 2 за творческата група
Взаимодейства ли? Защо?
Информационен отдел: Към кои класове органични съединения принадлежат издадените вещества? Какви функционални групи имат?
Задача 3 за творческата група
Информационен отдел: Към кои класове органични съединения принадлежат издадените вещества? Какви функционални групи имат?
(слайд номер 6)
„Мислещият ум не се чувства щастлив,
докато стане възможно да се свържат различни факти,
наблюдавано от него"
Д. Хевеси.
(слайд номер 7)
Б) Обсъждане на докладите на всяка група
Учител: А сега творческите групи трябва да докладват за свършената работа. Студент от химическа лаборатория разказва за своите наблюдения, които се случват по време на експеримента, като прави заключение за класа, с който взаимодейства сребърното съединение. По това време ученикът, който съставя информационния отдел, излиза и записва уравнението на реакцията за взаимодействието на органичната материя със сребърен оксид (I), като подчертава функционалната група на всеки клас.
Реакционният запис се проверява на съответния слайд № 8, 9, 10
Формулира се общ извод, че реагентът на Толенс (сребърно (I) съединение) е качествен за алдехидната група, която се намира в алдехидите, глюкозата и мравчена киселина. (слайд номер 11)
Урокът е обобщен.
„Радостта от виждането и разбирането
е най-красивият подарък
А. Айнщайн
(слайд номер 12)
Реакцията на сребърното огледало се използва за изработка на огледала, посребрени украси и коледни украси.
Качественият анализ на веществата е важна тема в изучаването на органичната химия. Познаването му помага не само на химици, но и на лекари, еколози, биолози, епидемиолози, фармацевти, работници в хранително-вкусовата промишленост.
Заключение. Обобщаване, оценяване. Благодаря за вниманието!
Инструкции за лабораторни експерименти
Реакция на сребърно огледало
Изсипете 2 ml 1% разтвор на сребърен нитрат AgNO 3 в епруветка и добавете 10% амонячна вода NH 4 OH на малки порции, докато образуваната утайка от сребърен оксид се разтвори напълно. (Или използвайте готов реагент на Толенс)
Добавете 1 ml към получения разтвор. изследваното вещество. Загрейте съдържанието, като завъртите епруветката около пламъка, загрявайки стените, а не дъното. Дръжте тръбата изправена.
1. Какво наблюдавате в епруветка?
2. Защо стъклената повърхност става огледална?
3. Напишете уравнението на реакцията.
Инструкции за лабораторни експерименти
Реакция на сребърно огледало
Изсипете 2 ml 1% разтвор на сребърен нитрат AgNO 3 в епруветка и добавете 10% амонячна вода NH 4 OH на малки порции, докато образуваната утайка от сребърен оксид се разтвори напълно. (Или използвайте готов реагент на Толенс)
Добавете 1 ml към получения разтвор. изследваното вещество. Загрейте съдържанието, като завъртите епруветката около пламъка, загрявайки стените, а не дъното. Дръжте тръбата изправена.
1. Какво наблюдавате в епруветка?
2. Защо стъклената повърхност става огледална?
3. Напишете уравнението на реакцията.
Инструкции за лабораторни експерименти
Реакция на сребърно огледало
Изсипете 2 ml 1% разтвор на сребърен нитрат AgNO 3 в епруветка и добавете 10% амонячна вода NH 4 OH на малки порции, докато образуваната утайка от сребърен оксид се разтвори напълно. (Или използвайте готов реагент на Толенс)
Добавете 1 ml към получения разтвор. изследваното вещество. Загрейте съдържанието, като завъртите епруветката около пламъка, загрявайки стените, а не дъното. Дръжте тръбата изправена.
1. Какво наблюдавате в епруветка?
2. Защо стъклената повърхност става огледална?
3. Напишете уравнението на реакцията.
Задача 1 творческа група
Химическа лаборатория: В епруветките има две органични вещества: глюкоза и етанол, осъществяват реакцията на взаимодействието на тези вещества с амонячен разтвор на сребърен оксид (I). Кое от веществата не взаимодейства? Защо?
Информационен отдел: Към кои класове органични съединения принадлежат издадените вещества? Какви функционални групи имат?
Задача 2 за творческата група
Химическа лаборатория: В епруветките има две органични вещества: формалдехид (формалин, метанал) и оцетна киселина, осъществяват реакцията на взаимодействието на тези вещества с амонячен разтвор на сребърен оксид (I). Кое от веществата взаимодейства? Защо?
Информационен отдел: Към кои класове органични съединения принадлежат издадените вещества? Какви функционални групи имат?
Задача 3 за творческата група
Химическа лаборатория: В епруветките има две органични вещества: мравчена киселина и глицерин, осъществяват реакцията на взаимодействието на тези вещества с амонячен разтвор на сребърен оксид (I). Кое от веществата не взаимодейства? Защо?
Информационен отдел: Към кои класове органични съединения принадлежат издадените вещества? Какви функционални групи имат?
Лаборатория № 5
Имотивъглехидрати
Експеримент 1. Реакция на сребърно огледалое реакция на възстановяване среброот амонячен разтвор сребърен оксид (Толенов реагент).
във воден разтвор амоняксребърният оксид се разтваря, за да образува комплексно съединение - диамминсребър(I) хидроксид ОН
когато се добави към което алдехидпротича редокс реакция с образуването на метално сребро:
Ако реакцията се извършва в съд с чисти и гладки стени, тогава среброто се утаява под формата на тънък филм, образувайки огледална повърхност.
При най-малко замърсяване среброто се отделя под формата на сива рохкава утайка.
Реакцията на сребърното огледало може да се използва като качествен тест за алдехиди. Така реакцията на "сребърното огледало" може да се използва като разграничение между глюкозаи фруктоза. Глюкозата принадлежи към алдозите (съдържащи отворена алдехидна група), а фруктозата принадлежи към кетозите (съдържащи отворена кето група). Следователно глюкозата дава реакция на "сребърно огледало", докато фруктозата не. Но ако в разтвора присъства алкална среда, тогава кетозите се изомеризират в алдози и също така дават положителни реакции с разтвор на амоняк сребърен оксид (Толенов реагент).
Качествена реакция на глюкоза с амонячен разтвор на сребърен оксид.Можете да докажете наличието на алдехидна група в глюкозата с помощта на амонячен разтвор на сребърен оксид. Добавете разтвор на глюкоза към амонячен разтвор на сребърен оксид и загрейте сместа на водна баня. Скоро метално сребро започва да се отлага по стените на колбата. Тази реакция се нарича реакция на сребърното огледало. Използва се като качество за откриване на алдехиди. Алдехидната група на глюкозата се окислява до карбоксилна група. Глюкозата се превръща в глюконова киселина.
CH 2 OH - (CHOH) 4 – СЪН+Ag 2 О= CH 2 OH - (CHOH) 4 – COOH + 2Ag↓

Редът на работата.
Изсипете 2 ml в две епруветки. амонячен разтвор на сребърен оксид. Към един от тях се добавят 2 мл. 1% разтвор на глюкоза, в друг - фруктоза. И двете тръби кипят.
Амонячен разтвор на сребърен хидроксид се получава чрез взаимодействие на сребърен нитрат с натриев хидроксид и амониев хидроксид:
AgNO3+ NaOH → AgOH↓+ NaNO3,
AgOH + 2 NH4 OH→[Ag(NH3)2] OH + H2O,
амонячен разтвор
OH + 3 H2 → Ag2O + 4 NH4 OH.
Принципът на метода. По стените на епруветката с глюкоза се образува огледало в резултат на отделянето на метално сребро.
Оформяне на работа: Заключението, както и хода и уравненията на реакцията напишете в тетрадка.
Опит 3. Качествена реакция към фруктоза
Принципът на метода. Когато проба с фруктоза се нагрява в присъствието на резорциноли на солна киселинадо 80 ° C след известно време в епруветка с фруктоза се появява яркочервен цвят.
Когато проба с фруктоза се нагрява в присъствието на резорциноли на солна киселинасе появява вишнево червен цвят. Анализът е приложим и за откриване на други кетоза. Алдозипри същите условия те взаимодействат по-бавно и дават бледорозов цвят или изобщо не си взаимодействат. отворен Ф. Ф. Селивановпрез 1887г. Използва се при анализ на урината. Тестът е положителен за фруктозурия от метаболитен или транспортен произход. В 13% от случаите тестът е положителен при хранителен товар от плодове и мед. Chem. формулафруктоза - C 6 H 12 O 6

Цикличната формула на фруктозата
Ациклична форма 
фруктоза
Боядисана връзка
R-остатък
хидроксиметилфурфурол
Редът на работата.
2 ml се изсипват в две епруветки: в едната - 1% разтвор на глюкоза, в другата - 1% разтвор на фруктоза. И двете епруветки се пълнят с 2 ml реактив на Селиванов: 0,05 g резорцинол се разтварят в 100 ml 20% солна киселина. И двете тръби се загряват леко до 80°C (преди кипене). Появява се червен цвят.

Изводи: резултатите от експеримента и уравнението на реакцията се записват в тетрадка.