Care este reacția oglinzii argintii? Experiment chimic: obținerea unei oglinzi de argint De ce reacția cu o soluție de amoniac de oxid de argint.
Laboratorul #5
Proprietățicarbohidrați
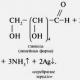
Experimentul 1. Reacția oglinzii de argint este o reacție de recuperare argint din soluție de amoniac oxid de argint (Reactiv Tollens).
in solutie apoasa amoniac oxidul de argint se dizolvă pentru a forma un compus complex - hidroxid de diamminesilver(I) OH
când se adaugă la care aldehidă are loc o reacție redox cu formarea argintului metalic:
Dacă reacția se desfășoară într-un vas cu pereți curați și netezi, atunci argintul precipită sub formă de peliculă subțire, formând o suprafață oglindă.
În prezența celei mai mici contaminări, argintul este eliberat sub formă de precipitat cenușiu liber.
Reacția oglindă de argint poate fi folosită ca test calitativ pentru aldehide. Astfel, reacția „oglinzii de argint” poate fi folosită ca o distincție între glucozăși fructoză. Glucoza aparține aldozelor (conținând o grupă aldehidă deschisă), iar fructoza aparține cetozelor (conținând o grupă ceto deschisă). Prin urmare, glucoza dă o reacție de „oglindă de argint”, în timp ce fructoza nu. Dar dacă în soluție este prezent un mediu alcalin, atunci cetozele izomerizează în aldoze și, de asemenea, dau reacții pozitive cu o soluție de amoniac oxid de argint (Reactiv Tollens).
Reacția calitativă a glucozei cu soluția de amoniac de oxid de argint. Puteți dovedi prezența unei grupări aldehide în glucoză folosind o soluție de amoniac de oxid de argint. Adăugați o soluție de glucoză la soluția de amoniac de oxid de argint și încălziți amestecul într-o baie de apă. În curând, argintul metalic începe să se depună pe pereții balonului. Această reacție se numește reacția oglindă de argint. Este folosit ca calitate pentru descoperirea aldehidelor. Gruparea aldehidă a glucozei este oxidată la o grupare carboxil. Glucoza este transformată în acid gluconic.
CH 2 OH - (CHOH) 4 – SOMMN+Ag 2 O= CH 2 OH - (CHOH) 4 – COOH + 2Ag↓

Ordinea lucrării.
Se toarnă 2 ml în două eprubete. soluție de amoniac de oxid de argint. La unul dintre ele se adaugă 2 ml. Soluție de glucoză 1%, în alta - fructoză. Ambele tuburi fierb.
O soluție de amoniac de hidroxid de argint se obține prin reacția azotatului de argint cu hidroxid de sodiu și hidroxid de amoniu:
AgNO3+ NaOH → AgOH↓+ NaNO3,
AgOH + 2 NH4 OH→[Ag(NH3)2] OH + H2O,
soluție de amoniac
OH + 3 H2 → Ag2O + 4 NH4 OH.
Principiul metodei. O oglindă se formează pe pereții eprubetei cu glucoză ca urmare a eliberării de argint metalic.
Proiectarea lucrării: scrieți concluzia, precum și cursul și ecuațiile reacției într-un caiet.
Experiență 3. Reacție calitativă la fructoză
Principiul metodei. Când o probă cu fructoză este încălzită în prezența de resorcinolși de acid clorhidric până la 80 ° C după un timp apare o culoare roșie aprinsă într-o eprubetă cu fructoză.
Când o probă cu fructoză este încălzită în prezența de resorcinolși de acid clorhidric apare o culoare roșu vișiniu. Testul este aplicabil și pentru detectarea altora cetoza. Aldoze in aceleasi conditii interactioneaza mai lent si dau o culoare roz pal sau nu interactioneaza deloc. deschis F. F. Selivanovîn 1887. Este utilizat în analiza urinei. Testul este pozitiv pentru fructozurie de origine metabolică sau de transport. În 13% din cazuri, testul este pozitiv cu o încărcătură alimentară de fructe și miere. Chim. formulă fructoză - C 6 H 12 O 6

Formula ciclică a fructozei
Forma aciclică 
fructoză
Conexiune vopsită
R-rezidu
hidroximetilfurfural
Ordinea lucrării.
Se toarnă 2 ml în două eprubete: într-una - soluție de glucoză 1%, în cealaltă - soluție de fructoză 1%. Ambele tuburi sunt umplute cu 2 ml de reactiv Selivanov: 0,05 g de resorcinol se dizolvă în 100 ml de acid clorhidric 20%. Ambele tuburi sunt încălzite ușor la 80°C (înainte de fierbere). Apare o culoare roșie.

Concluzii: rezultatele experimentului și ecuația reacției sunt scrise într-un caiet.
Continuăm subiectul experimentelor chimice, pentru că sperăm să vă placă cu siguranță. De data aceasta va prezentam atentiei o alta experienta fascinanta, in timpul careia vom primi o oglinda argintie.
Să începem prin a viziona videoclipul
Noi vom avea nevoie:
- capacitate;
- nitrat de argint;
- apa fierbinte;
- solutie de amoniac 10%;
- glucoza;
- arzator cu alcool

Să începem cu nitratul de argint. Luăm aproximativ un gram din el și îl diluăm într-o cantitate mică de apă fierbinte.

Apoi, la soluția rezultată se adaugă hidroxid de sodiu. În timpul acestei reacții se formează oxid de argint, care precipită.

Apoi, adăugați o soluție de amoniac 10% la precipitatul de oxid de argint. Este necesar să turnați soluția de amoniac până când precipitatul se dizolvă.

În timpul acestei reacții, se formează amoniac de argint. Adăugați 5 grame de glucoză la soluția rezultată.

Acum trebuie să încălziți amestecul rezultat. Pentru a face acest lucru, aprindem arzătorul cu alcool și punem pe el un pahar, astfel încât amestecul să se încălzească treptat. În timpul acestei reacții, se eliberează o cantitate foarte mare de amoniac, așa că această reacție trebuie efectuată fie sub o hotă, fie în aer liber. În timpul reacției se poate forma și nitritul de argint, care este o substanță foarte periculoasă, așa că vasele trebuie spălate bine după reacție.


După ceva timp, un strat subțire de argint începe să se așeze treptat pe pereții cupei. Reacția este finalizată după aproximativ 15 minute după începerea încălzirii.


Pentru a obține un strat mai uniform de argint, trebuie să puneți un pahar cu amestecul într-un recipient mare, să turnați apă fierbinte în recipient și să-l puneți pe un arzător cu alcool. Temperatura va fi astfel distribuită uniform, iar rezultatul va fi mai spectaculos.
Conducerea unui curs opțional „Experiment în chimie organică”
Studiul lecției
Lucrarea practică nr. 3 „Reacția oglinzii de argint”
Subiect: Studiul interacțiunii compușilor organici de diferite clase cu compușii de argint (I).
Scopul lecției:
educațional general
Investigați interacțiunea claselor de compuși organici cu compușii de argint, aflați motivul alegerii acestei interacțiuni.
Educational
Dezvoltarea abilităților de gândire, comparare, analiză, sinteza abilităților cognitive. Capacitatea de a pune și pune o întrebare, de a formula o problemă, de a trage concluzii; îmbunătățirea abilităților de comportament independent.
Didactic
Să-și formeze competențe în domeniul activității cognitive independente, abilități de lucru în echipă, capacitatea de a vedea problema și de a schița modalități de rezolvare a acesteia.
Educational
Formarea gândirii viziunii asupra lumii, lărgirea orizontului, formarea unei atitudini pozitive față de studiul subiectului, obiceiul de a ajuta tovarășii, o atitudine conștiincioasă față de sarcina îndeplinită și dezvoltarea exigenței față de sine și tovarăși.
Metode: cercetare, lucru cu literatură educațională, căutare parțială, lucru de laborator, lucru în grup.
Echipamente: Pe mesele elevilor se află instrumente și reactivi pentru lucrul de laborator „Reacția în oglindă de argint”, fișe de sarcini, prezentare pentru lecție.
În timpul orelor
1. Moment organizatoric
„Vremea miracolelor a trecut și noi
Caut motive
Tot ce se întâmplă în lume”
W. Shakespeare
(diapozitivul numărul 1)
Discurs introductiv al profesorului : Toți cei care au o idee despre știința chimiei știe că o parte integrantă a acesteia este un experiment chimic. Experimentele distractive și exercițiile practice ajută la dezvoltarea gândirii chimice și contribuie la asimilarea chimiei. Cursul opțional „Studiarea chimiei organice printr-un sistem de probleme experimentale” este conceput pentru 17 ore 12 - lucrări practice. Majoritatea lucrărilor practice sunt efectuate de grupuri mici de studenți. Lucrarea cursului este structurată după cum urmează. Elevii primesc sarcini pe tema lucrărilor practice viitoare. Acasă, se familiarizează cu materialul teoretic, studiază conținutul lucrării în sine.
Astăzi facem lucrarea practică nr. 3 (vezi titlul de mai sus)
(diapozitivul numărul 2)
Scopul acestei lucrări: investigarea experimentală a interacțiunii claselor de compuși organici cu compușii de argint, aflarea motivului alegerii acestei interacțiuni, consolidarea abilităților practice necesare în activitățile experimentatorului.
(diapozitivul numărul 3)
Elevii au primit o sarcină preliminară pentru lecție.
Profesor : Reacția de interacțiune a compusului de argint se numește „reacția oglindă a argintului”. Spune povestea obținerii acestei oglinzi.
1 student : Istoricul achizițiilor de oglindă. Oglinzi... Segoziua este un lucru foarte comun în viața noastră. Puțini oameni știu că oglinzile au apărut cu mult înaintea erei noastre. La început, erau plăci de metal lustruite până la o strălucire din aur, argint, cupru sau bronz. Fabricarea oglinzilor de tip modern (pe sticlă) a fost inițiată în 1858 de chimistul german Justus Liebig. El a folosit pentru aceasta capacitatea cationilor de argint de a forma numeroși compuși complecși.Odată, după spălarea suprafeței interioare a balonului cu o soluție de sifon, apoi cu apă, alcool etilic și eter dietilic, Liebig a turnat în ea puțină formol diluat - o soluție de formaldehidă 10%. Apoi, adăugând la formol o soluție de amoniac de argint din compoziție, a încălzit cu grijă balonul.După câteva minute, balonul a devenit o oglindă.
Cationul complex care conține argint este redus la metal (argint), iar formaldehida este oxidată la acid formic HCOOH. Ulterior, în loc de formol, Justus Liebig a folosit glucoză pentru a obține o „oglindă de argint”.
Profesor : Povestește-ne despre istoria obținerii reactivului Tollens, care este utilizat pe scară largă în chimia analitică.
2 elev: Istoricul obținerii reactivului lui Tollens. În 1881, chimistul german Bernhard Christian Tollens a propus utilizarea unui compus complex de argint pentru a detecta compuși cu o grupă aldehidă în soluție. Când se adaugă o soluție apoasă de amoniac la o soluție de azotat de argint, apare un precipitat de oxid cenușiu-negru, deoarece hidroxidul de argint nu există în condiții normale.
2AgNO 3 + 2NH 4 OH → Ag 2 O + 2NH 4 NO 3 + H 2 O
Oxidul de argint se dizolvă în excesul de apă cu amoniac, formează un complex unitate.
Ag2O + 4NH4OH → 2OH + 3H2O
Soluția incoloră rezultată a fost numită reactiv Tollens.
2. Corpul principal
„Este imposibil să devii chimist în vreun fel,
Fără a vedea practica în sine
și să nu preia operațiuni chimice"
M.V. Lomonosov
(diapozitivul numărul 4)
A) Joc de rol: Clasa este un laborator de cercetare care își începe activitatea privind studiul interacțiunii diferitelor clase de compuși organici cu compușii de argint (I). Elevii sunt împărțiți în trei grupuri creative. Fiecare grup de creație are un departament de informare și un laborator de chimie. Grupele primesc sarcini și lucrări teoretice și practice (5-7 min). Odată cu sarcina, sunt emise instrucțiuni pentru implementarea experimentului. (diapozitivul numărul 5)
Sarcina 1 grup creativ
Sarcina 2 pentru grupul creativ
Interacționează? De ce?
Departamentul de informații: Căror clase de compuși organici aparțin substanțele emise? Ce grupe funcționale au?
Sarcina 3 pentru grupul creativ
Departamentul de informații: Căror clase de compuși organici aparțin substanțele emise? Ce grupe funcționale au?
(diapozitivul numărul 6)
„Mintea gânditoare nu se simte fericită,
până când este posibil să legați împreună fapte disparate,
observat de el"
D. Hevesy.
(diapozitivul numărul 7)
B) Discutarea rapoartelor fiecărui grup
Profesor: Și acum grupurile creative ar trebui să raporteze despre munca depusă. Un student al unui laborator de chimie vorbește despre observațiile sale care au loc în timpul experimentului, făcând o concluzie despre clasa cu care interacționează compusul de argint. În acest moment, elevul care alcătuiește catedra de informare iese și notează ecuația reacției pentru interacțiunea materiei organice cu oxidul de argint (I), evidențiind grupa funcțională a fiecărei clase.
Înregistrarea reacției este verificată pe lama corespunzătoare nr. 8, 9,10
Se formulează o concluzie generală că reactivul Tollens (compusul de argint (I)) este calitativ pentru grupa aldehidă, care se găsește în aldehide, glucoză și acid formic. (diapozitivul numărul 11)
Lecția este rezumată.
„Bucuria de a vedea și de a înțelege
este cel mai frumos cadou
A. Einstein
(diapozitivul numărul 12)
Reacția oglinzii de argint este folosită pentru fabricarea oglinzilor, decorațiunilor de argint și decorațiunilor de Crăciun.
Analiza calitativă a substanțelor este un subiect important în studiul chimiei organice. Cunoașterea acestuia îi ajută nu numai pe chimiști, ci și pe medici, ecologisti, biologi, epidemiologi, farmaciști și lucrători din industria alimentară.
Concluzie. Rezumat, notare. Vă mulțumim pentru atenție!
Instrucțiuni pentru experimentul de laborator
Reacția oglinzii argintii
Se toarnă 2 ml de soluție 1% de azotat de argint AgNO 3 într-o eprubetă și se adaugă 10% apă cu amoniac NH 4 OH în porții mici până când precipitatul format de oxid de argint este complet dizolvat. (Sau utilizați reactiv Tollens gata preparat)
Adăugați 1 ml la soluția rezultată. substanta studiata. Încălziți conținutul rotind eprubeta în jurul flăcării, încălzind mai degrabă pereții decât fundul. Țineți tubul în poziție verticală.
1. Ce observați într-o eprubetă?
2. De ce suprafața de sticlă devine ca o oglindă?
3. Scrieți ecuația reacției.
Instrucțiuni pentru experimentul de laborator
Reacția oglinzii argintii
Se toarnă 2 ml de soluție 1% de azotat de argint AgNO 3 într-o eprubetă și se adaugă 10% apă cu amoniac NH 4 OH în porții mici până când precipitatul format de oxid de argint este complet dizolvat. (Sau utilizați reactiv Tollens gata preparat)
Adăugați 1 ml la soluția rezultată. substanta studiata. Încălziți conținutul rotind eprubeta în jurul flăcării, încălzind mai degrabă pereții decât fundul. Țineți tubul în poziție verticală.
1. Ce observați într-o eprubetă?
2. De ce suprafața de sticlă devine ca o oglindă?
3. Scrieți ecuația reacției.
Instrucțiuni pentru experimentul de laborator
Reacția oglinzii argintii
Se toarnă 2 ml de soluție 1% de azotat de argint AgNO 3 într-o eprubetă și se adaugă 10% apă cu amoniac NH 4 OH în porții mici până când precipitatul format de oxid de argint este complet dizolvat. (Sau utilizați reactiv Tollens gata preparat)
Adăugați 1 ml la soluția rezultată. substanta studiata. Încălziți conținutul rotind eprubeta în jurul flăcării, încălzind mai degrabă pereții decât fundul. Țineți tubul în poziție verticală.
1. Ce observați într-o eprubetă?
2. De ce suprafața de sticlă devine ca o oglindă?
3. Scrieți ecuația reacției.
Sarcina 1 grup creativ
Laborator chimic: În eprubete sunt două substanțe organice: glucoză și etanol, efectuează reacția de interacțiune a acestor substanțe cu o soluție de amoniac de oxid de argint (I). Care dintre substanțe nu interacționează? De ce?
Departamentul de informații: Căror clase de compuși organici aparțin substanțele emise? Ce grupe funcționale au?
Sarcina 2 pentru grupul creativ
Laborator chimic: În eprubete sunt două substanțe organice: formaldehida (formalină, metanal) și acid acetic, realizează reacția de interacțiune a acestor substanțe cu o soluție de amoniac de oxid de argint (I). Care dintre substante interactioneaza? De ce?
Departamentul de informații: Căror clase de compuși organici aparțin substanțele emise? Ce grupe funcționale au?
Sarcina 3 pentru grupul creativ
Laborator chimic: În eprubete sunt două substanțe organice: acid formic și glicerina, realizează reacția de interacțiune a acestor substanțe cu o soluție de amoniac de oxid de argint (I). Care dintre substanțe nu interacționează? De ce?
Departamentul de informații: Căror clase de compuși organici aparțin substanțele emise? Ce grupe funcționale au?
Laboratorul #5
Proprietățicarbohidrați
Experimentul 1. Reacția oglinzii de argint este o reacție de recuperare argint din soluție de amoniac oxid de argint (Reactiv Tollens).
in solutie apoasa amoniac oxidul de argint se dizolvă pentru a forma un compus complex - hidroxid de diamminesilver(I) OH
când se adaugă la care aldehidă are loc o reacție redox cu formarea argintului metalic:
Dacă reacția se desfășoară într-un vas cu pereți curați și netezi, atunci argintul precipită sub formă de peliculă subțire, formând o suprafață oglindă.
În prezența celei mai mici contaminări, argintul este eliberat sub formă de precipitat cenușiu liber.
Reacția oglindă de argint poate fi folosită ca test calitativ pentru aldehide. Astfel, reacția „oglinzii de argint” poate fi folosită ca o distincție între glucozăși fructoză. Glucoza aparține aldozelor (conținând o grupă aldehidă deschisă), iar fructoza aparține cetozelor (conținând o grupă ceto deschisă). Prin urmare, glucoza dă o reacție de „oglindă de argint”, în timp ce fructoza nu. Dar dacă în soluție este prezent un mediu alcalin, atunci cetozele izomerizează în aldoze și, de asemenea, dau reacții pozitive cu o soluție de amoniac oxid de argint (Reactiv Tollens).
Reacția calitativă a glucozei cu soluția de amoniac de oxid de argint. Puteți dovedi prezența unei grupări aldehide în glucoză folosind o soluție de amoniac de oxid de argint. Adăugați o soluție de glucoză la soluția de amoniac de oxid de argint și încălziți amestecul într-o baie de apă. În curând, argintul metalic începe să se depună pe pereții balonului. Această reacție se numește reacția oglindă de argint. Este folosit ca calitate pentru descoperirea aldehidelor. Gruparea aldehidă a glucozei este oxidată la o grupare carboxil. Glucoza este transformată în acid gluconic.
CH 2 OH - (CHOH) 4 – SOMMN+Ag 2 O= CH 2 OH - (CHOH) 4 – COOH + 2Ag↓

Ordinea lucrării.
Se toarnă 2 ml în două eprubete. soluție de amoniac de oxid de argint. La unul dintre ele se adaugă 2 ml. Soluție de glucoză 1%, în alta - fructoză. Ambele tuburi fierb.
O soluție de amoniac de hidroxid de argint se obține prin reacția azotatului de argint cu hidroxid de sodiu și hidroxid de amoniu:
AgNO3+ NaOH → AgOH↓+ NaNO3,
AgOH + 2 NH4 OH→[Ag(NH3)2] OH + H2O,
soluție de amoniac
OH + 3 H2 → Ag2O + 4 NH4 OH.
Principiul metodei. O oglindă se formează pe pereții eprubetei cu glucoză ca urmare a eliberării de argint metalic.
Proiectarea lucrării: scrieți concluzia, precum și cursul și ecuațiile reacției într-un caiet.
Experiență 3. Reacție calitativă la fructoză
Principiul metodei. Când o probă cu fructoză este încălzită în prezența de resorcinolși de acid clorhidric până la 80 ° C după un timp apare o culoare roșie aprinsă într-o eprubetă cu fructoză.
Când o probă cu fructoză este încălzită în prezența de resorcinolși de acid clorhidric apare o culoare roșu vișiniu. Testul este aplicabil și pentru detectarea altora cetoza. Aldoze in aceleasi conditii interactioneaza mai lent si dau o culoare roz pal sau nu interactioneaza deloc. deschis F. F. Selivanovîn 1887. Este utilizat în analiza urinei. Testul este pozitiv pentru fructozurie de origine metabolică sau de transport. În 13% din cazuri, testul este pozitiv cu o încărcătură alimentară de fructe și miere. Chim. formulă fructoză - C 6 H 12 O 6

Formula ciclică a fructozei
Forma aciclică 
fructoză
Conexiune vopsită
R-rezidu
hidroximetilfurfural
Ordinea lucrării.
Se toarnă 2 ml în două eprubete: într-una - soluție de glucoză 1%, în cealaltă - soluție de fructoză 1%. Ambele tuburi sunt umplute cu 2 ml de reactiv Selivanov: 0,05 g de resorcinol se dizolvă în 100 ml de acid clorhidric 20%. Ambele tuburi sunt încălzite ușor la 80°C (înainte de fierbere). Apare o culoare roșie.

Concluzii: rezultatele experimentului și ecuația reacției sunt scrise într-un caiet.